Le remboursement des traitements en France
La Voix des Migraineux se mobilise depuis sa création en 2018 pour le remboursement de tous les traitements pour soulager les patients, qu’il s’agisse de traitements de fond ou de traitements de crise.
Vous retrouverez ici les explications concrètes sur le parcours d’un médicament pour l’obtention de son remboursement, ainsi que l’ensemble des dossiers portés par l’association auprès de la Haute Autorité de Santé pour ce faire.

Avant qu’un médicament soit disponible et remboursé en pharmacie, il doit passer par de nombreuses étapes. Pour vous aider à mieux comprendre ce processus, voici des explications simplifiées mais nous l’espérons, claires.
1️⃣ Les essais cliniques
2️⃣ Le laboratoire dépose une demande d’Autorisation de Mise sur le Marché (AMM).
Aux États-Unis, la Food and Drug Administration (FDA) est chargée de la mise sur le marché des médicaments. En Europe, c’est l’European Medicines Agency (EMA) qui est responsable de l’évaluation scientifique des demandes centralisées d’AMM. Elle est appelée Agence européenne des médicaments (AEM) en français.
Une fois accordée par la Commission européenne, l’AMM centralisée est valable dans tous les États membres de l’Union européenne (UE).
Elle comporte :
3️⃣ La commercialisation
Une fois obtenue l’AMM, le laboratoire peut commercialiser le médicament sans remboursement dans tous les pays de l’UE. Cette commercialisation ne peut se faire que dans le respect des recommandations de l’EMA.
4️⃣ Le laboratoire peut demander le remboursement du produit.
👉🏽 Dépôt de dossier et contribution
Le laboratoire constitue un dossier qu’il dépose à la Commission de la Transparence (CT) de la Haute Autorité de Santé (HAS).
La Commission de la Transparence est une instance scientifique composée de médecins, pharmaciens, et spécialistes en méthodologie et épidémiologie. Elle évalue les médicaments ayant obtenu leur AMM, lorsque le laboratoire qui les commercialise souhaite obtenir leur inscription sur la liste des médicaments remboursables.
Dans le cadre de l’évaluation en vue de remboursement, les associations peuvent déposer une contribution (voir les contributions de la Voix des Migraineux médicament par médicament dans la partie précédente).
Les patients disposent d’un savoir spécifique sur leur maladie. L’expérience sur le vécu de la maladie, les traitements existants, les parcours de soins, les besoins, enrichit l’évaluation des médicaments et des dispositifs médicaux. La HAS évalue l’utilité, le progrès apporté et l’efficience des technologies de santé en vue de définir l’intérêt de les rembourser ou d’en maintenir le remboursement par l’Assurance maladie.
👉🏽 Avis de la CT et attribution des notes (SMR et ASMR)
La Commission de la Transparence s’appuie sur le dossier du laboratoire, la contribution de l’association et sur les données sur le sujet pour évaluer le médicament, et lui attribuer 2 notes :
- Service Médical Rendu : le médicament présente-t-il un intérêt pour le traitement de la pathologie. Elle attribue les notes : léger, modéré, important.
- Amélioration du Service Médical Rendu. La commission compare puis évalue si le traitement apporte un avantage par rapport aux traitements existants dans la même pathologie. Les notes vont de I à V (1 à 5). V (5) étant la plus mauvaise note, elle correspond à « absence de progrès thérapeutique ».
Partout dans le monde, les essais cliniques se font contre placebo. Il est donc compliqué pour un nouveau traitement de prouver qu’il fait mieux qu’un autre. Il n’y a que très rarement des essais cliniques contre comparateur.
La Commission de la Transparence de la HAS ne rend qu’un avis, que le gouvernement est libre de suivre ou pas..
👉🏽 CEPS et la fixation des prix
Une fois l’avis officiel publié, le dossier est transmis à la Commission d’Évaluation des Produits de Santé (CEPS).
Le CEPS (Comité économique des produits de santé) contribue à l’élaboration de la politique du médicament, il met en œuvre les orientations qu’il reçoit des ministres compétents. En particulier, le comité applique ces orientations à la fixation des prix des médicaments, au suivi des dépenses et à la régulation financière du marché. Pour mener cette action le comité peut conclure avec les entreprises ou groupes d’entreprises des conventions portant sur le prix des médicaments.
C’est le CEPS qui mène les négociations de prix avec les laboratoires en prenant en compte les orientations ministérielles et les lois, dont celle du comparateur, évaluée par l’AMSR.
Médicament avec une note d’ASMR V (5) : il ne peut être inscrit au remboursement que s’il apporte une économie dans les coûts de traitement. En clair, le médicament ne pourra être remboursé que s’il coûte moins cher que le comparateur. Et ce, quels que soient les coûts de fabrication du médicament.
À ce stade, le gouvernement peut décider d’annuler les négociations. Le laboratoire ne pourra pas présenter ses arguments.
Si les négociations aboutissent, et qu’un accord de prix est obtenu entre le laboratoire et le gouvernement, le dossier est transmis à la Direction de la sécurité sociale. Celle-ci se charge de mettre en œuvre le remboursement. Ensuite, viennent la Caisse nationale d’assurance maladie et la Branche risques professionnels.
Schéma du circuit d’évaluation des médicaments par la Haute Autorité de Santé en France.
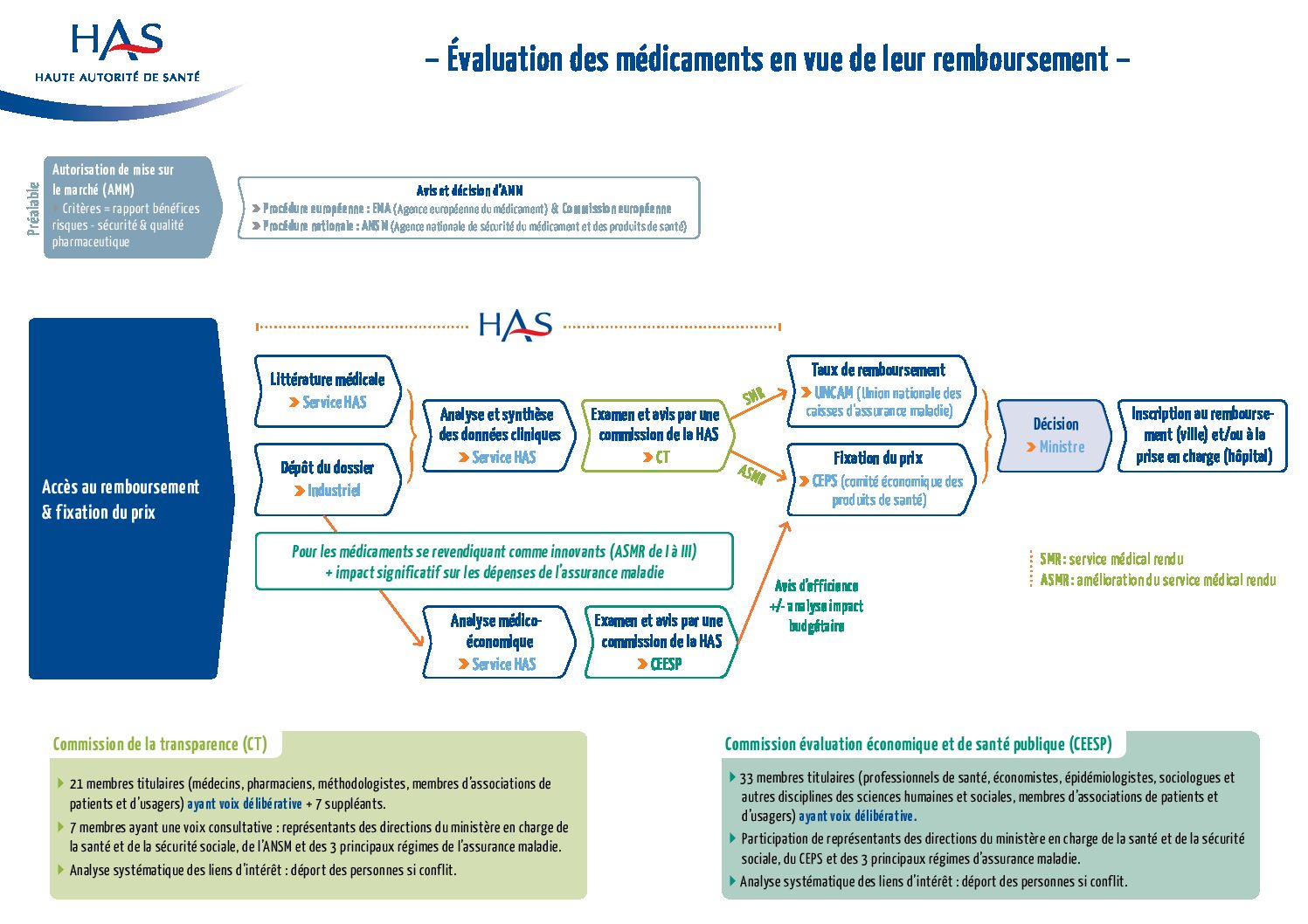
Les critères de la Haute Autorité de Santé sont le service médical rendu, et l’amélioration de celui-ci.

En dépit d’un besoin médical non couvert, reconnu officiellement par la Commission de la Transparence, le gouvernement refuse le remboursement des anti-CGRP, tant que des études avec comparateur n’auront pas eu lieu.
Et ce, en allant à l’encontre des droits des patients. Selon l’article 1110-5 du Code de santé publique :
Toute personne a le droit de recevoir des soins visant à soulager sa douleur. Celle-ci doit être en toute circonstance prévenue, évaluée, prise en compte et traitée. » (…) Toute personne a (…) le droit de recevoir (…) les traitements et les soins les plus appropriés et de bénéficier des thérapeutiques dont l’efficacité est reconnue.
Les traitements classiques de la migraine.
Ils sont utilisés depuis plusieurs décennies et sont tous remboursés. Ce sont en majorité des traitements non spécifiques : beta-bloquants, antidépresseurs et anti-epileptiques pour les traitements de fond. Parmi, les traitements de crises , on retrouve les anti-inflammatoire non stéroïdens et les triptans. Ces derniers ont été pendant très longtemps les seuls traitements spécifiques de la migraine.
Les nouveaux traitements spécifiques pour lesquels l’association a contribué.
Pratiquement à la naissance de l’association en 2018, de nouveaux traitements sont apparus. L’association n’a eu de cesse d’agir pour en obtenir le remboursement. Voici les nouveaux traitement pour lesquels l’association a contribué afin d’obtenir un remboursement :
Pour rappel, les critères de prescriptions des anti-CGRP sont : patients souffrant de plus de 8 jours de migraine par mois, en échec d’au moins 2 traitements de fond et ne présentant pas d’antécédents cardio-vasculaires.
Pour connaître l’histoire des anti-CGRP, vous pouvez lire notre article sur le sujet.
Les anti-CGRP ne sont actuellement pas remboursés en France.
À l’hôpital :
Sur prescription d’un neurologue, AJOVY®, EMGALITY® et AIMOVIG® peuvent être pris en charge uniquement à l’hôpital. Cette situation est inacceptable dans la mesure où l’administration du produit ne nécessite pas un acte à l’hôpital. De plus, cela pèse sur leur budget.
VYPETI® est disponible uniquement à l’hôpital et est aussi pris en charge sur la réserve hospitalière.
Commercialisation en pharmacie :
Sur prescription d’un neurologue uniquement, AJOVY® et EMGALITY® sont commercialisés en pharmacie mais non remboursés par l’assurance-maladie. La pharmacie doit s’adresser au laboratoire pour commander le produit. Les prix se situent entre 245 € et 270 €. Certaines pharmacies font des efforts. Il faut faire jouer la concurrence. AIMOVIG® n’est pas commercialisé en pharmacie.
Aide à la prise en charge financière :
Les mutuelles ont toutes des services sociaux pour les dépenses exceptionnelles, il peut s’agir d’aides financières, d’aides sociales exceptionnelles ou autre dénomination. Pour effectuer la demande, il faut remplir un dossier et fournir de nombreux justificatifs sur vos ressources, vos charges, des devis ou factures liés aux anti-CGRP. Nous ne pouvons bien entendu pas nommer de mutuelles en particulier, mais des patients sont parvenus à obtenir une aide : osez faire la démarche !Il vous faudra être patient et tenace car les mutuelles demandent une preuve du refus de prise en charge par la CPAM (prise en charge classique, aide sociale exceptionnelle), vous aurez donc à réaliser cette dernière en amont.
Les avis de la Commission de la Transparence pour les 4 anti-CGRP présentés, AIMOVIG®, AJOVY®, EMGALITY® et VYEPTI®, comportent tous un SMR (service médical rendu) important ce qui signifie que l’importance de leur utilité dans le traitement des migraines est reconnue. Ces avis confirment ainsi qu’il existe un besoin non couvert pour une certaine catégorie de malades. Ces deux points ont été en très grande partie obtenus grâce aux contributions de La Voix des Migraineux.
Cependant, les 4 produits ont obtenu un AMSR (amélioration du service médical rendu) de V (5) faute d’étude contre comparateur. Celle réalisée pour AIMOVIG® n’a pas été reconnue comme convaincante. Et l’association ne peut pas réaliser ces études, le coût est énorme.
📢 Nous avons multiplié les démarches et les entretiens avec tous les acteurs, et également réalisé plusieurs enquêtes pour étayer nos arguments. Ces enquêtes ont d’ailleurs beaucoup compté pour l’obtention du SMR important. Merci à toutes les personnes qui ont répondu.
Sollicités par des membres et adhérents de l’association, plusieurs députés et sénateurs ont questionné le gouvernement. Il y a 4 ou 5 ans, le gouvernement arguait du manque de preuves scientifiques pour refuser le remboursement. Cet argument ne tenant plus devant le nombre de pays en Europe et dans le monde remboursant les traitements, il s’appuie à présent sur la loi du comparateur qui fait qu’un traitement ne peut être remboursé plus cher qu’un traitement jugé équivalent.
💡 Les anti-CGRP sont des médicaments récents reposant sur une technologie innovante. Ce sont des médicaments basés sur des processus biologiques. Leurs procédés de fabrication sont complexes et coûteux. L’administration par injection ajoute le prix du stylo injecteur (surcoût), dont la fabrication doit de plus être très rigoureuse. Il est impossible de les vendre quelques euros. Les traitements existants ont été conçus il y a des décennies. À titre de comparaison, cela équivaudrait à vendre le mobile dernier cri au prix du premier, apparu dans les années 90.
Voici les informations détaillées, par anti-CGRP :
AIMOVIG® a obtenu un avis favorable au remboursement en mars 2019. Malheureusement, avec une note d’ASMR à V (5) correspondant à « Pas de progrès thérapeutique », le gouvernement refuse le remboursement par la CPAM. Fin 2020, AIMOVIG® peut être prescrit à l’hôpital mais sur leur budget déjà réduit. Enfin, il faut savoir qu’il n’est pas commercialisé en pharmacie.
En février 2022, AIMOVIG® est repassé à la Commission de la transparence pour une réévaluation. Malheureusement, l’ASMR reste de V (5). Le dossier de La Voix des Migraineux a été salué. Celui du laboratoire n’a pas suffisamment convaincu. Nous sommes intervenus à tous les niveaux du système de santé.
🔎 Retrouvez les documents officiels autour de la demande de remboursement d’AIMOVIG® – érénumab sur le site de la HAS : ici
• 2ème synthèse de l’avis de la HAS sur AIMOVIG®, 30 mars 2022
• Notre contribution pour AIMOVIG®, 30 juillet 2021 (30 pages)
À l’issue de l’évaluation d’EMGALITY® en juin 2020, la note d’AMSR est de V (5). Le gouvernement refuse le remboursement par la CPAM. Fin 2020, EMGALITY® a pu être prescrit sur la réserve hospitalière avec un budget de l’hôpital déjà limité.
En mars 2021, grâce à la demande conjointe du SFEMC et de La Voix des Migraineux, EMGALITY® est commercialisé dans les pharmacies françaises sur prescription d’un neurologue.
🔎 Retrouvez les documents officiels autour de la demande de remboursement d’EMGALITY® – galcanézumab sur le site de la HAS : ici
• Évaluation de la Commission de la transparence, 24 juin 2020
• Notre contribution pour EMGALITY® n’apparait pas sur le site de la HAS, mais a bien été envoyée le 25 mars 2020 (26 pages disponibles sur demande).
À l’issue de l’évaluation d’AJOVY® en septembre 2020 la note d’ASMR est de V (5). Le gouvernement refuse le remboursement par la CPAM. Début 2021, AJOVY® a pu être prescrit sur la réserve hospitalière, toujours sur un budget de l’hôpital limité.
Le laboratoire TEVA a présenté un nouveau dossier en février 2022. La Voix des Migraineux a apporté sa contribution. La commission a eu lieu et malheureusement, AJOVY® a une nouvelle fois obtenu un AMSR de V (5), le remboursement est refusé.
🔎 Retrouvez les documents officiels autour de la demande de remboursement d’AJOVY® – frémanézumab sur le site de la HAS : ici
• 2ème évaluation de la Commission de la transparence, 14 septembre 2022
• Notre contribution pour AJOVY®, 6 avril 2022 (36 pages)
📢 En 2024, la Commission de la Transparence étudie de nouveau le dossier d’évaluation en vue d’un remboursement. La Voix des migraineux a soumis une nouvelle contribution le 7 octobre 2024. Pour cela, l’association s’est appuyé sur les 101 résultats obtenus de l’enquête « La vie avec AJOVY®« . La commission de la transparence étudiera le dossier du laboratoire, les données scientifiques existantes et la contribution de l’association. Un avis sera donné sous 2 ou 3 mois.
VYEPTI® a obtenu l’AMM au niveau européen en janvier 2022. Le traitement VYEPTI® s’administre en intraveineuse tous les 3 mois à l’hôpital. L’accès en est limité par les places disponibles en hôpital de jour. Cependant, cela se met en œuvre progressivement.
🔎 Retrouvez les documents officiels autour de la demande de remboursement de VYEPTI® – eptinézumab sur le site de la HAS : ici
• Évaluation de la Commission de la transparence, 5 octobre 2022
• Notre contribution pour VYEPTI®, 30 juin 2022 (48 pages)
Il est à noter qu’il ne s’agit pas d’un remboursement à proprement parler, mais d’une « prise en charge par la collectivité », c’est-à-dire sur le budget de l’hôpital.
Les gépants se présentent sous la forme de petits comprimés oraux ou de comprimés solubles, alors que les anticorps monoclonaux CGRP sont sous forme injectable.
Voici les informations détaillées, par gépant :
AQUIPTA® 60 mg est un gépant destiné à être pris en traitement de fond. Il a obtenu l’AMM en août 2023 en traitement préventif de la migraine. Les résultats de l’évaluation en vue de remboursement ont été publiés le 8 janvier 2024. Malheureusement, bien que le SMR soit considéré comme important par la commission, l’ASMR est de V (5) et reste insuffisant faute d’essais cliniques contre comparateurs.
Des essais cliniques sont toujours en cours, à Clermont-Ferrand et Paris, et ailleurs dans le monde.
Il est commercialisé en France depuis le mois de juin 2024 par le laboratoire. Cependant, il n’est pas remboursé par l’assurance maladie.
🔎 Retrouvez les documents officiels autour de la demande de remboursement de AQUIPTA® – atogépant sur le site de la HAS : ici
-Évaluation de la Commission de la transparence, 22 novembre 2023
-Notre contribution pour AQUIPTA®, 7 octobre 2023 (36 pages)
Le VYDURA® est un traitement sublingual de type gépant destiné à être pris en traitement de crise. Il a également l’AMM en traitement préventif de la migraine. Il s’agit d’un antagoniste du récepteur du CGRP (peptide lié au gène de la calcitonine), un peptide qui contribue au développement de la migraine. En inhibant ce récepteur, VYDURA® empêche la liaison avec le CGRP et soulage la crise ou prévient l’apparition des crises.
Ayant obtenu l’AMM européenne, il est commercialisé depuis octobre 2023 mais non remboursé. C’est une avancée, notamment pour les patients pour qui les triptans sont contre-indiqués.
Des essais cliniques sont en cours en France et ailleurs dans le monde.
Le prix exorbitant reste un obstacle (40 à 80 € le comprimé).
Malheureusement, aucune demande d’évaluation en vue de remboursement n’a été déposée.
La toxine botulique (ou botulinique) de type A, ou BOTOX®, constitue un traitement de fond de la migraine chronique. Il est dispensé à l’hôpital et pris en charge sur le budget de l’hôpital (il ne s’agit donc pas d’un remboursement à proprement parler).
Le BOTOX® est déjà disponible depuis plus de 10 ans dans la majorité des pays du monde.
🔎 Retrouvez les documents officiels autour de la demande de remboursement du BOTOX® sur le site de la HAS : ici
-Évaluation de la Commission de la transparence, 17 Novembre 2021
-Notre contribution pour le BOTOX®, (21 pages)
Le sumatriptan est la version générique du 1er traitement de crise pour la migraine, de la famille des triptans. Il existe sous plusieurs formes : comprimé, spray nasal, seringue injectable. Il est remboursé sous le forme de comprimés et de spray nasal. Deux autres formes de ce traitement existent.
Voici les informations détaillées :
SUMATRIPTAN SUN® est un triptan en seringue injectable, de 3 mg/0,5 ml. Il est utilisé en cas de crise de migraine, sur prescription.
Il a obtenu l’AMM le 9 mars 2020, est commercialisé en France depuis 2021, mais n’est pas remboursé par l’assurance maladie.
🔎 Retrouvez les documents officiels autour de la demande de remboursement de SUMATRIPTAN SUN® sur le site de la HAS : ici
-Évaluation de la Commission de la transparence, 5 octobre 2022
-Notre contribution pour Sumatriptan®, 1er septembre 2022 (32 pages)
NOMANESIT® est une association de sumatriptan (triptan) et de naproxène (AINS). Il se présente en comprimé de 85 mg de sumatriptan et 500 mg de naproxène sodique. Des spécialistes ont publié un article scientifique sur ce produit : Sumatriptan-naproxen sodium in migraine : A review.
Leur conclusion est que l’association des deux molécules fonctionne mieux que prendre les comprimés séparément.
Cette association est commercialisée aux USA depuis 2008 sous l’appellation TREXIMET®.
À l’issue de l’évaluation de NOMANESIT® en décembre 2024 par la HAS, la note d’AMSR est de V (5). Le médicament n’est pas remboursé par l’assurance santé.
🔎 Retrouvez les documents officiels autour de la demande de remboursement de NOMANESIT® sur le site de la HAS : ici
-Évaluation de la Commission de la transparence, 18 décembre 2024
-Notre contribution pour NOMANESIT® (30 pages)
CONCLUSION DE L’ASSOCIATION
La Voix des Migraineux n’a cessé de rédiger des contributions de qualité (entre 30 et 50 pages d’analyse) afin de convaincre la Commission de la Transparence de la Haute Autorité de Santé et le gouvernement du bien-fondé d’un remboursement.
C’est un travail de longue haleine mobilisant plusieurs bénévoles et Sabine Debremaeker, la présidente de l’association qui représente les patients auprès de ces instances.
Mais les critères d’ASMR sont pour le moment un frein pour ces traitements qui n’ont pas de comparateurs.
Nous ne lâchons rien, nous gardons espoir.

Sources :
HAS, Commission de la transparence
ansm
Rédigé par Sabine DEBREMAEKER
Mise à jour en décembre 2024.
